潛力無限!城大化學家研發新型的獨特RNA結構靶向工具,為癌症治療研究提供新思路
負責將儲存在DNA內的遺傳密碼解碼並產生蛋白質的核糖核酸(Ribonucleic acids, RNAs),會摺疊成不同的結構,以控制包括人類在內的各種生物的基本生理過程。而透過小分子來找出與疾病相關的RNA結構,一直是科學界研發靶向RNA藥物(RNA-targeting drugs)的金科玉律。最近,香港城市大學(城大)的研究團隊便開發了一種新型的RNA結構靶向工具,毋須靶向小分子,依然能針對地識別出與癌症和神經系統疾病等有關的獨特四鏈(four-stranded)RNA結構。團隊的發現或有助於進一步開發出相關疾病的治療工具。
研究由來自城大化學系及海洋污染國家重點實驗室的副教授郭駿傑博士領導,研究結果已於學術期刊《Nature Protocols》上發表,題為〈Development of RNA G-quadruplex (rG4) targeting L-RNA aptamers by rG4-SELEX〉。
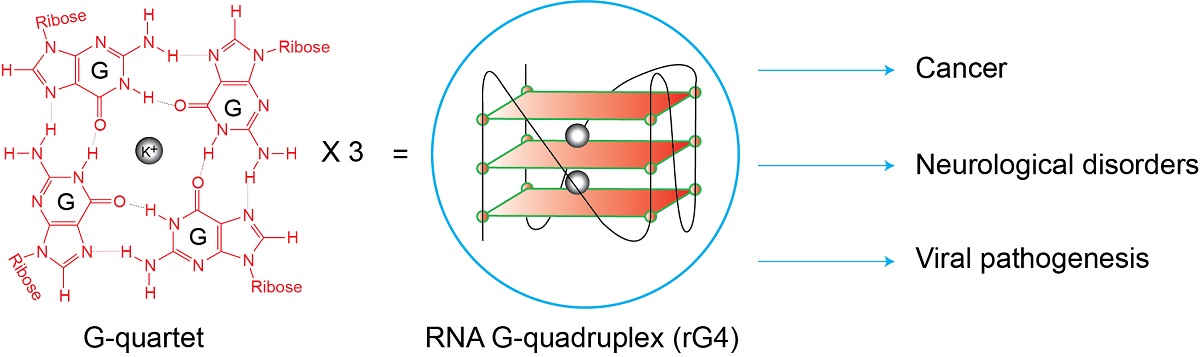
與癌症和神經系統疾病相關的RNA G-四鏈體
郭博士說:「我們是全球首個研究團隊,成功研發出一種新型的工具,能夠靶向RNA G-四鏈體(RNA G-quadruplex,簡稱rG4)的L-RNA核酸適體(aptamers)。我們的研究數據表明,這些新開發的L-RNA核酸適體能選擇性地靶向特定的rG4目標,並精準地與之結合,表現更比現時最前沿的rG4靶向小分子更好。」他形容團隊的研究成果「令人鼓舞」,並說:「我們的成果為選擇性靶向rG4提供了嶄新及重要的方向,而且可能適用於靶向DNA和RNA中其他不常見的核酸結構。」
那到底什麼是RNA G-四鏈體呢?RNA G-四鏈體簡稱rG4,是由RNA序列形成的一種特殊結構,見於人類、植物、細菌和病毒中,能成為結構「支架」讓蛋白質結合形成,並發揮不同的生物學功能。個別的rG4已被發現於細胞中具有重要的功能和扮演基因調控的角色,近期的研究還發現了rG4與癌症、神經系統疾病和病毒致病機理有關。
而要進一步鑽研rG4,首先就要找到它們。一直以來,靶向功能性rG4的主要方法是運用小分子配體(ligands),即是分子量(molecular weight)輕的有機或無機化合物。郭博士解釋道:「不過大多數的rG4配體都無法區分具有相似結構的rG4,這對要選擇性靶向指定rG4以進行基因調控,構成一大挑戰。」
全新解決方案︰以嶄新L-RNA核酸適體靶向rG4
為克服上述挑戰,郭博士和他的團隊研發出「基於L-RNA核酸適體以靶向rG4」的全新解決方案,為科研界解決長期存在的問題。核酸適體是單鏈、短的DNA或RNA分子,摺疊成特定結構,並與金屬離子和蛋白質等特定目標結合。
郭博士和團隊花上將近兩年的時間,建立起他們命名為「rG4-SELEX」的核酸適體揀選平台,研發出可以靶向特定rG4的不同L-RNA核酸適體。
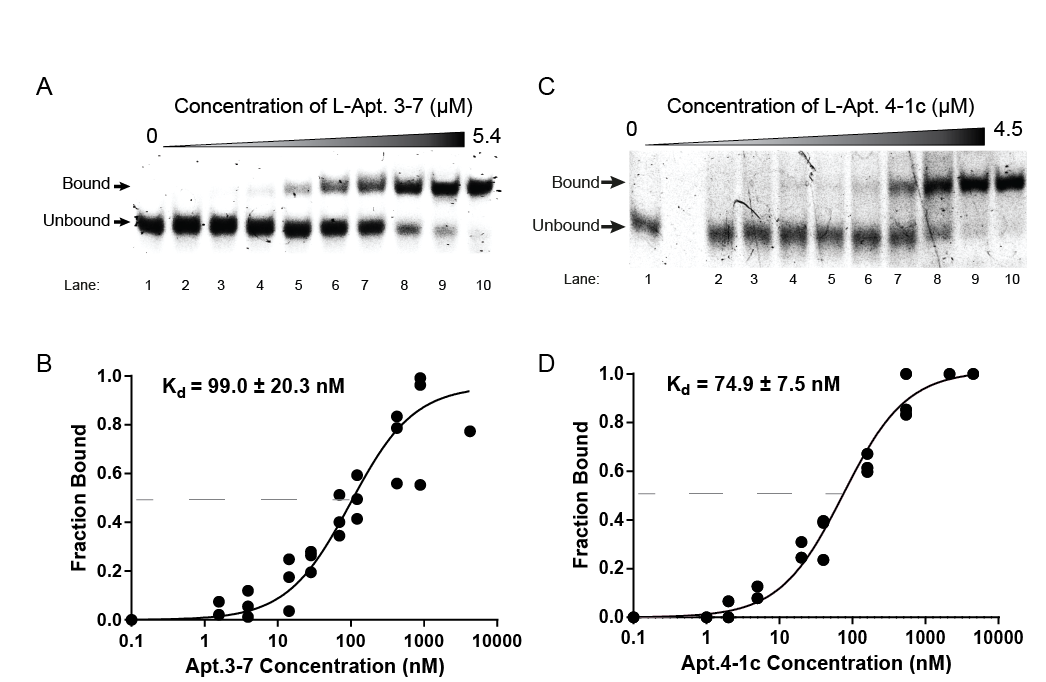
他們在實驗中發現,被他們稱為「L-Apt.3-7」的其中一種L-RNA核酸適體,可以與其目標rG4緊密結合,而且在實驗中沒有混淆其他類似的rG4結構。這個結果可謂是首次發現到運用L-RNA核酸適體,可以選擇性靶向rG4。
團隊還證明了L-RNA核酸適體可用來干擾rG4與蛋白質之間的相互作用,從而截停其生化和細胞功能,加以調控的話,或可作治療。根據團隊的實驗結果,相對於目前最前沿的rG4靶向配體,L-RNA核酸適體的表現可以匹敵,甚至有過之而無不及。
潛力無限,日後或可用於治療疾病
郭博士總結說:「在這次研究中,我們首次引入了能幫助大力開發L-RNA核酸適體的通用框架,以用於靶向與生物學和治療相關的rG4結構,和找出rG4-蛋白質之間的相互作用。我們的研究結果提供了新的靶向策略,日後或可用於治療疾病。」
郭博士和他的團隊目前正研究以靶向rG4的L-RNA核酸適體,來靶向人體的編碼RNA和解碼RNA之中數個與疾病相關的rG4結構,和rG4-蛋白質的相互作用。

郭博士預計進一步完善這個核酸適體揀選的平台後,將能夠用高通量的方式開發出不同的L-核酸適體,以靶向RNA結構,從而或可應用於治療如 COVID-19的人類疾病。他補充說:「我堅信追求技術上的創新自然會推動我們探索生物學,並衍生更深入的理解。」
郭博士是論文的通訊作者。而來自城大化學系及海洋污染國家重點實驗室的Umar Mubarak Ishaq博士和陳俊彥先生均是第一作者。
是次研究獲得城大、香港研究資助局、裘槎基金會、深圳市基礎研究項目和香港城大海洋污染國家重點實驗室的資助而進行。
DOI number: 10.1038/s41596-022-00679-6
