检测早期脑肿瘤的崭新非侵入性液态活检技术
恶性神经胶质瘤是最常见的一种原发脑癌,由于难以在早期被诊断等问题,因此确诊时多已是晚期,几近药石无灵。近期,香港城市大学(香港城大)一支跨学科的研究团队便在血清中新发现一种生物标志物,透过他们改良的无标记式生物传感器,能定量检测出这种标志物,以便在早期就能检测出神经胶质瘤。研究成果令对神经胶质瘤进行非侵入性的液态活检变得可行,有望成为未来具有潜力的诊断工具。
该项研究由香港城大神经科学系的李永镇博士,以及材料科学及工程学系胡志文教授共同领导。研究成果已在学术期刊《科学进展》(Science Advances)上发表,题为〈Label-free sensing of exosomal MCT1 and CD147 for tracking metabolic reprogramming and malignant progression in glioma〉。
癌细胞的代谢特征
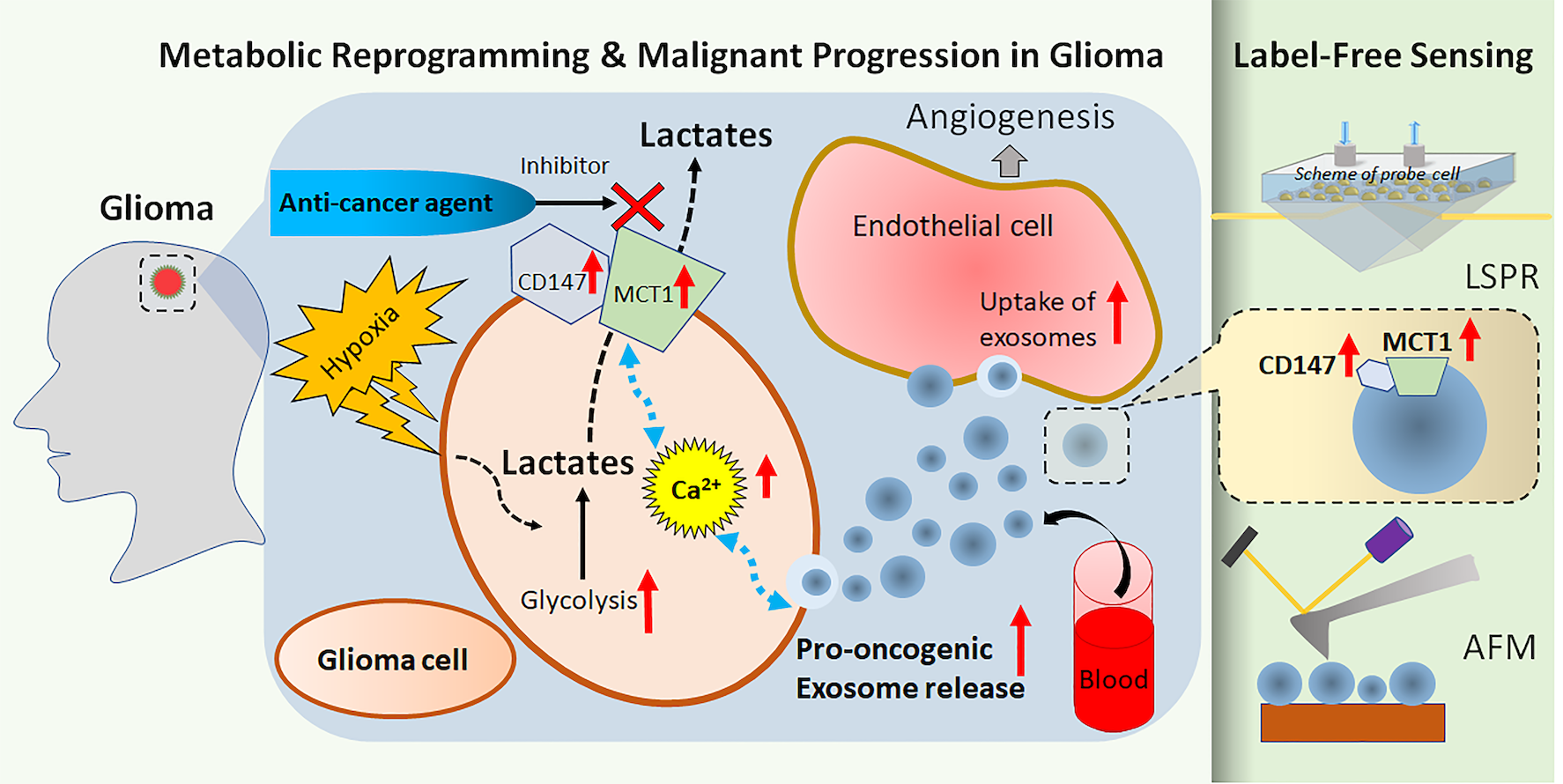
恶性神经胶质瘤细胞增生时的一个特征,是肿瘤细胞为了生存而出现的一种代谢途径重编程(metabolic reprogramming)现象。与正常细胞相比,癌细胞可以在没有氧气的情况下存活;而且即使在氧含量正常的情况下,癌细胞仍会偏好利用糖酵解(glycolysis)来制造能量,促进癌细胞的存活及增生。糖酵解本身是指无氧下,将葡萄糖转化为高能分子的代谢过程。因此,肿瘤细胞的糖酵解往往被称为“有氧糖酵解"(aerobic glycolysis)或瓦伯格效应(Warburg’s effect),以便与正常细胞的无氧糖酵解分别出来。
糖酵解的过程会产生出大量的乳酸,对癌细胞有害,因此癌细胞会制造出更多的单羧酸转运蛋白1(MCT1,一种主要的乳酸转运蛋白)和它们的结合蛋白CD147,作用是将乳酸排走到细胞之外,令糖酵解得以维持进行,持续产生能量,令肿瘤细胞存活。所以,很多研究都提出,神经胶质瘤细胞中的MCT1和CD147,可以被视为诊断和治疗恶性神经胶质瘤的生物标志物。
不过,本身是神经科学家的李博士说:“尽管大多数研究都集中钻研神经胶质瘤细胞或基因,但是我们对神经胶质瘤细胞通过外泌体(exosomes)与附近的细胞所产生的相互作用更感兴趣。"
外泌体是直径大约为30至200纳米的囊泡,由神经胶质瘤细胞释放出来,含有与肿瘤相关的信使核糖核酸(messenger RNA, mRNA)和变异的蛋白质。外泌体亦会将致癌分子转运到邻近细胞,以促进肿瘤的生长。外泌体更可以穿过血脑屏障(the blood-brain-barrier)和血脑脊液屏障(the blood-cerebrospinal fluid barrier),因此可以在血液中被检测到。
外泌体中新发现的生物标志物
在这次研究中,团队发现神经胶质瘤细胞中的MCT1和CD147实际上控制了外泌体的释放以及其成份。论文的第一作者、神经科学系的研究助理Abhimanyu Thakur博士说:“这个发现意味着减少MCT1和CD147的数量能达致抗癌的效果:不单能抑制癌细胞的生长,亦可以透过外泌体阻止癌细胞与附近细胞的互动,例如阻截外泌体将致癌分子转运到其他细胞。”
更重要的是,研究团队发现外泌体亦含有MCT1和CD147,而且当神经胶质瘤细胞在缺氧环境下增生时,外泌体中的MCT1和CD147的水平都升高了。研究团队进行的定量分析进一步显示,外泌体中的MCT1和CD147的水平,能够反映神经胶质瘤细胞中的MCT1和CD147水平。这意味着外泌体中的MCT1和CD147亦可用作追踪恶性神经胶质瘤增生的生物标志物。
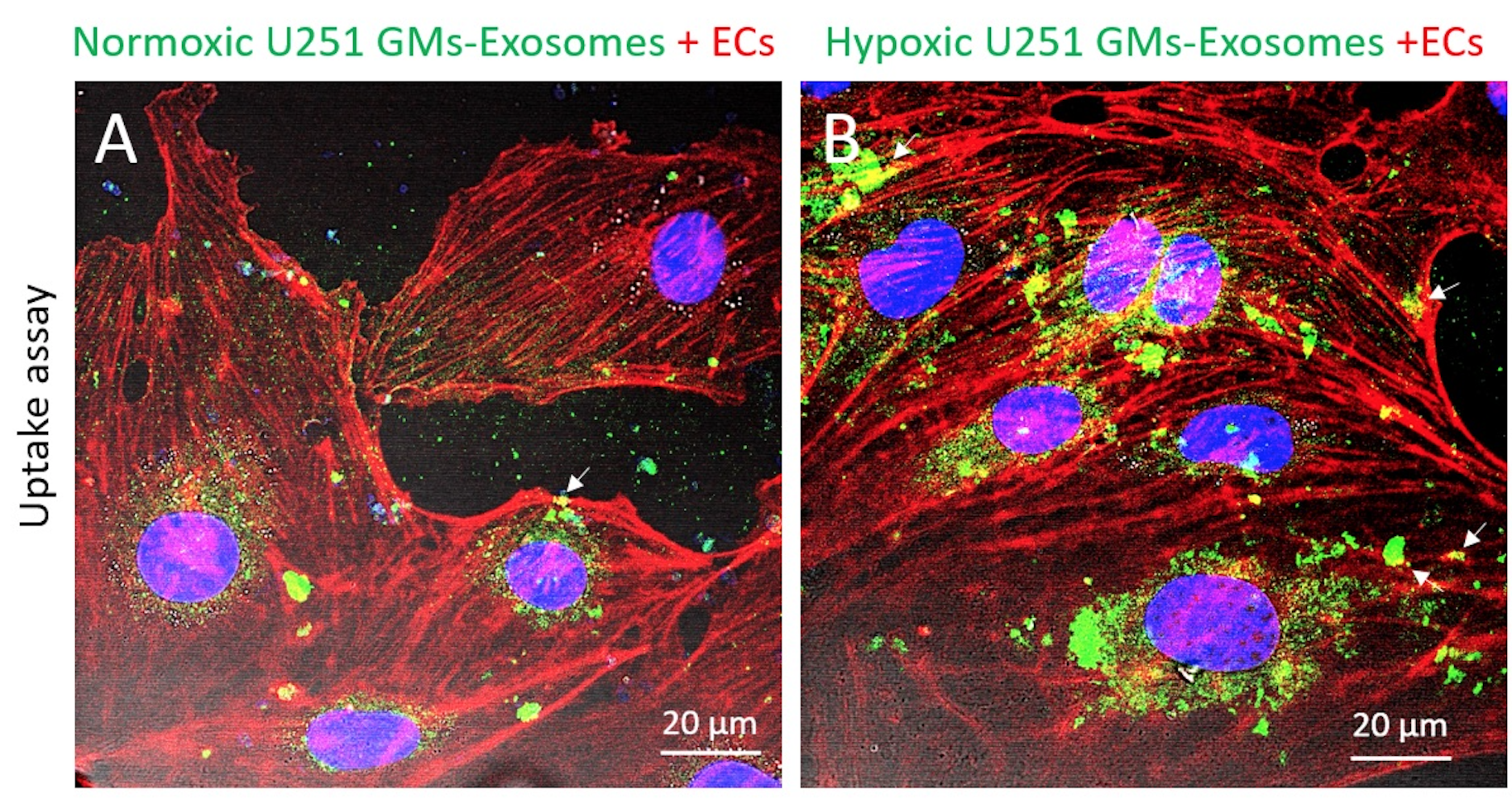
非侵入性兼无标记式的传感技术
那么如何量度外泌体中的MCT1和CD147的水平呢?
目前医学界主要用核磁共振成像(MRI)、计算机断层成像扫描(CT)以及脑部组织活检,来诊断和追踪病人神经胶质瘤的增生情况。但是碍于分辨率有限,MRI和CT扫描无法在分子层面上进行检测,大多只能确认已发展至较晚期的神经胶质瘤,而活检的方法则具侵入性,均有其不足之处。
研究团队运用由吴教授及其博士生们改良了的局域表面等离子体共振(localized surface plasmon resonance, LSPR)生物传感器和原子力显微镜(atomic force microscopy, AFM)生物传感器,成功准确定量检测到由神经胶质瘤细胞释放的外泌体中的MCT1和CD147水平。

LSPR技术透过侦测置于传感器表面的测试溶液在折射率上的微小变化,可检测出不同单一分子间的相互作用,包括抗原与抗体之间或蛋白质与蛋白质之间的相互作用,是一种具有高灵敏度的技术。而AFM则是具有高分辨率(精细至纳米级)的扫描探针显微镜,用于分析外泌体等生物样本。
LSPR和AFM这两种方式都具有成本效益、实时、灵敏度高的特性,而且“无需标志物”,意思是检测时不需要用上造影剂。胡教授解释道:“一般标示标志物的过程既费工夫又昂贵。这次我们运用无标记式的生物传感技术,在不用为外泌体作标记的情况下,仍然能检测到它们。”

胡教授的团队改良LSPR和AFM的方法,是在传感器芯片的表面加上一层特别的纳米金颗粒层。师从胡教授、参与此项研究的博士生徐晨解释说:「这个做法不仅可以提升LSPR的灵敏度,也令AFM有更高的分辨率。」
为了测试经改良的LSPR和AFM生物传感器的性能,研究团队使用了分别由培植的人脑神经胶质瘤细胞所释放的外泌体,以及从患有神经胶质瘤小鼠的血清里分离出来的外泌体,来进行实验。实验所得出的正面结果,强而有力地证明了LSPR和AFM生物传感器在监测神经胶质瘤细胞的恶性增生具有应用潜力,有望应用于早期检测及作更佳的诊断。
或可应用于检测神经疾病
“我们的研究显示,神经细胞的代谢变化可以透过改变外泌体的相互作用而加促疾病演进。进一步研究神经疾病中,代谢途径重编程与外泌体和其他细胞互动改变,这两者之间的关联,会是个有趣的课题。”李博士补充说。“透过使用无标记式的LSPR和AFM生物传感器来检测外泌体生物标志物,或可应用于阿兹海默症、柏金逊症和肌萎缩性脊髓侧索硬化症等神经系统疾病的诊断。”
研究团队的成员均来自香港城大。除了李博士、胡教授、Thakur博士以及徐晨,其他成员包括来自神经科学系的杨甜、来自MSE学系的邱广宇博士和吴兆鹏博士、以及来自生物医学工程学系的陈苇恩博士与韩雄奇。

这项研究获得香港城大及香港研究资助局的资助进行。
DOI number: 10.1126/sciadv.aaz6119
本文已于 “香港城大研创” 微信公众号发布。
Wechat ID: CityU_Research

